Weitere Gebrauchsinformationen der Varianten von bupre
Dieses Präparat ist rezeptpflichtig.
-35/-52,5/-70 Mikrogramm/Stunde transdermales Pflaster
1 Was ist Bupre - 1 A Pharma und wofür wird es angewendet?
Der Wirkstoff in Bupre - 1 A Pharma ist Buprenorphin.
Bupre - 1 A Pharma ist ein Analgetikum (ein schmerzlinderndes Arzneimittel), das bei mäßig starken bis starken Tumorschmerzen und bei starken Schmerzen, die nicht auf andere Arten von Schmerzmitteln ansprechen, angewendet wird. Bupre - 1 A Pharma wirkt über die Haut. Buprenorphin ist ein Opioid (starkes Schmerzmittel), das den Schmerz durch seine Wirkung im zentralen Nervensystem (an spezifischen Nervenzellen des Rückenmarks und des Gehirns) verringert. Die Wirkung des transdermalen Pflasters hält bis zu vier Tage an. Bupre - 1 A Pharma ist nicht zur Behandlung von akuten (kurz andauernden) Schmerzen geeignet.
2 Was sollten Sie vor der Anwendung von Bupre - 1 A Pharma beachten?
Bupre - 1 A Pharma darf nicht angewendet werden,
- wenn Sie allergisch gegen Buprenorphin oder einen der in Abschnitt 6 genannten sonstigen Bestandteile dieses Arzneimittels sind
- wenn Sie an einer Abhängigkeit von starken Schmerzmitteln (Opioide) leiden
- wenn Sie an Krankheiten mit starken Atembeschwerden leiden
- wenn Sie gleichzeitig Monoaminoxidase (MAO)-Hemmstoffe (bestimmte Arzneimittel, die gegen Depression wirken) einnehmen oder innerhalb der letzten 2 Wochen eingenommen haben (siehe „Anwendung von Bupre - 1 A Pharma zusammen mit anderen Arzneimitteln“)
- wenn Sie an Myasthenia gravis (bestimmte schwere krankhafte Muskelschwäche) leiden
- wenn Sie an Delirium tremens (geistige Verwirrung und Zitteranfälle, die bei Alkoholentzug nach gewohnheitsmäßigem exzessivem Trinken oder während einer Phase von starkem Alkoholkonsum auftreten) leiden
- wenn Sie schwanger sind.
Bupre - 1 A Pharma darf nicht als Ersatzmittel beim Drogenentzug eingesetzt werden.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, bevor Sie Bupre - 1 A Pharma anwenden
- wenn Sie vor Kurzem viel Alkohol getrunken haben
- wenn Sie zu Epilepsie oder zu Krampfanfällen neigen
- wenn Sie an einer Bewusstseinsstörung leiden, deren Ursache nicht bekannt ist (wenn Sie sich benommen oder einer Ohnmacht nahe fühlen)
- wenn Sie sich im Schockzustand befinden (kalter Schweiß kann ein Anzeichen dafür sein)
- wenn Sie an erhöhtem Hirndruck (z. B. nach Kopfverletzungen oder bei Erkrankungen des Gehirns) leiden und eine künstliche Beatmung nicht möglich ist
- wenn Sie Atembeschwerden haben oder gleichzeitig Arzneimittel anwenden, die ebenfalls dämpfend oder schwächend auf die Atmung wirken können (siehe „Anwendung von Bupre - 1 A Pharma zusammen mit anderen Arzneimitteln“)
- wenn Sie ein Leberleiden haben
- wenn Sie zu Arzneimittel- oder Drogenmissbrauch neigen.
Bitte beachten Sie auch die folgenden Vorsichtsmaßnahmen:
- Bei einigen Patienten kann sich eine Abhängigkeit von starken Schmerzmitteln wie z. B. Bupre - 1 A Pharma einstellen, wenn diese über einen längeren Zeitraum angewendet werden. In diesem Fall können Entzugserscheinungen auftreten, wenn die Anwendung beendet wird (siehe Abschnitt 3 „Wenn Sie die Anwendung von Bupre - 1 A Pharma abbrechen“).
- Fieber und äußerliche Wärmeanwendung können die Hautdurchlässigkeit steigern, wodurch der Wirkstoff Buprenorphin in größerer Menge ins Blut gelangt. Ebenfalls kann eine äußere Wärmeanwendung dazu führen, dass das Pflaster nicht mehr ausreichend klebt. Sprechen Sie daher mit Ihrem Arzt, wenn Sie Fieber haben, und vermeiden Sie äußerliche Wärmeanwendung (z. B. Sauna, Infrarot-Bestrahlung, elektrische Heizdecken, Wärmflaschen).
Auswirkungen bei Fehlgebrauch zu Dopingzwecken Die Anwendung dieses Arzneimittels kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Kinder und Jugendliche
Bupre - 1 A Pharma soll nicht von Patienten unter 18 Jahren angewendet werden, da noch keine Erfahrungen für diese Altersgruppe vorliegen.
Anwendung von Bupre - 1 A Pharma zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben oder beabsichtigen, andere Arzneimittel einzunehmen/anzuwenden.
- Bupre - 1 A Pharma darf nicht zusammen mit Monoaminoxidase (MAO)-Hemmstoffen (bestimmte Arzneimittel zur Behandlung von Depressionen) angewendet werden oder wenn Sie innerhalb der letzten 2 Wochen MAOHemmstoffe eingenommen haben.
- Bupre - 1 A Pharma kann bei manchen Menschen zu Benommenheit, Übelkeit oder Ohnmachtsanfällen führen. Es kann zur Verlangsamung oder Abflachung der Atmung kommen. Die gleichzeitige Anwendung von Arzneimitteln, die ebenfalls diese Wirkungen besitzen, kann zu einer Verstärkung der Nebenwirkungen von Bupre - 1 A Pharma führen. Zu diesen Arzneimitteln gehören andere starke Schmerzmittel (Opioide), bestimmte Schlafmittel, Narkosemittel und Arzneimittel zur Behandlung von bestimmten seelischen Erkrankungen, wie z. B. Beruhigungsmittel, Antidepressiva und Neuroleptika.
- Wenn Sie Bupre - 1 A Pharma zusammen mit bestimmten anderen Arzneimitteln anwenden, kann die Wirkung des transdermalen Pflasters verstärkt werden. Zu diesen Arzneimitteln zählen z. B. bestimmte Antiinfektiva/Antimykotika (z. B. mit dem Wirkstoff Erythromycin oder Ketoconazol) oder Arzneimittel gegen HIV (z. B. mit dem Wirkstoff Ritonavir).
- Wenn Sie Bupre - 1 A Pharma zusammen mit anderen Arzneimitteln anwenden, kann die Wirkung des transdermalen Pflasters verringert werden. Zu diesen Arzneimitteln zählen z. B. Dexamethason, Arzneimittel gegen Epilepsie (z. B. mit dem Wirkstoff Carbamazepin oder Phenytoin) oder Arzneimittel gegen Tuberkulose (z. B. Rifampicin).
Anwendung von Bupre - 1 A Pharma zusammen mit Nahrungsmitteln, Getränken und Alkohol
Trinken Sie keinen Alkohol, während Sie Bupre - 1 A Pharma anwenden. Alkohol kann bestimmte Nebenwirkungen des transdermalen Pflasters verstärken, und es kann sein, dass Sie sich unwohl fühlen.
Schwangerschaft und Stillzeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Es liegen keine hinreichenden Erfahrungen mit der Anwendung von Bupre - 1 A Pharma bei Schwangeren vor. Daher dürfen Sie Bupre - 1 A Pharma nicht während der Schwangerschaft anwenden.
Buprenorphin, der Wirkstoff im transdermalen Pflaster, hemmt die Milchbildung und geht in die Muttermilch über. Daher sollten Sie Bupre - 1 A Pharma nicht während der Stillzeit anwenden.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Bupre - 1 A Pharma kann Schwindel, Müdigkeit, verschwommenes Sehen sowie Doppelt-Sehen verursachen und Ihr Reaktionsvermögen so beeinträchtigen, dass Sie nicht angemessen und schnell genug auf unerwartete oder plötzliche Ereignisse reagieren können. Dies trifft besonders zu
- zu Beginn der Behandlung
- im Falle von Dosierungsänderungen
- wenn Sie von einem anderen Schmerzmittel auf Bupre - 1 A Pharma wechseln
- wenn Sie andere Arzneimittel anwenden, die auf Ihr Gehirn einwirken
- wenn Sie Alkohol trinken.
Tritt eines der oben erwähnten Symptome während der Behandlung mit Bupre - 1 A Pharma bei Ihnen auf, so dürfen Sie weder ein Fahrzeug führen noch Maschinen bedienen. Dies trifft auch nach Beenden der Behandlung zu. Bis zu 24 Stunden nach Entfernen des Pflasters sollten Sie weder ein Fahrzeug führen noch Maschinen bedienen.
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie sich nicht sicher sind.
3 Wie ist Bupre - 1 A Pharma anzuwenden?
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
Bupre - 1 A Pharma ist in drei Stärken erhältlich: Bupre - 1 A Pharma 35 Mikrogramm/Stunde transdermales Pflaster, Bupre - 1 A Pharma 52,5 Mikrogramm/Stunde transdermales Pflaster und Bupre - 1 A Pharma 70 Mikrogramm/Stunde transdermales Pflaster.
Ihr Arzt entscheidet, welche Stärke von Bupre - 1 A Pharma für Sie am besten geeignet ist. Während der Behandlung kann der Arzt Sie, wenn es sich als notwendig erweist, auf ein schwächeres oder stärkeres Pflaster umstellen.
Die empfohlene Dosis beträgt:
Erwachsene
Kleben Sie ein Bupre - 1 A Pharma transdermales Pflaster auf (so wie es unten ausführlich beschrieben ist) und wechseln Sie es spätestens jeden vierten Tag, außer Ihr Arzt hat Ihnen etwas anderes gesagt. Der Einfachheit halber können Sie das transdermale Pflaster zweimal wöchentlich an zwei festen Tagen wechseln, z. B. immer montagmorgens und donnerstagabends. Zur Erinnerung sollten Sie diese Tage im Kalender auf dem Umkarton vermerken. Wenn Ihr Arzt Ihnen zusätzlich zum transdermalen Pflaster weitere Schmerzmittel verordnet hat, dann befolgen Sie genau seine Anweisungen, andernfalls kann der vollständige Nutzen aus der Behandlung mit Bupre - 1 A Pharma nicht gezogen werden.
Ältere Patienten
Eine Anpassung der Dosierung ist bei älteren Patienten nicht erforderlich.
Patienten mit Nierenerkrankung/Dialyse-Patienten
Bei Patienten mit Nierenerkrankungen und bei Dialyse-Patienten ist keine Anpassung der Dosierung erforderlich.
Patienten mit Lebererkrankung
Bei Patienten mit Erkrankungen der Leber kann die Stärke und Dauer der Wirkung von Bupre - 1 A Pharma verändert sein. Wenn dies auf Sie zutrifft, wird Ihr Arzt Sie genauer untersuchen.
Anwendung bei Kindern und Jugendlichen
Bupre - 1 A Pharma soll nicht von Patienten unter 18 Jahren angewendet werden, da noch keine Erfahrungen für diese Altersgruppe vorliegen.
Art der Anwendung
Das Pflaster ist zur transdermalen Anwendung. Wenn das transdermale Pflaster auf der Haut klebt, wird der Wirkstoff Buprenorphin durch die Haut ins Blut aufgenommen.
Hinweise zur Anwendung
Vor Anwendung des transdermalen Pflasters
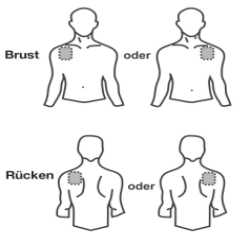
- Wählen Sie an Ihrem Oberkörper eine flache, saubere und unbehaarte Hautstelle aus, die frei von Wunden oder Narben ist, bevorzugt an der oberen Rückenpartie oder vorne unterhalb des Schlüsselbeins auf der Brust (siehe nachstehende Abbildungen). Lassen Sie sich von jemandem helfen, falls Sie das transdermale Pflaster nicht selbst anbringen können.
- Wenn die ausgewählte Hautstelle Haare aufweist, schneiden Sie diese mit einer Schere ab. Rasieren Sie die Haare nicht!
- Vermeiden Sie Hautstellen, die gerötet oder gereizt sind oder andere Schäden, z. B. größere Narben, aufweisen.
- Die Hautstelle, die Sie ausgewählt haben, muss trocken und sauber sein. Falls erforderlich, reinigen Sie sie mit kaltem oder lauwarmem Wasser. Benutzen Sie keine Seife oder andere Reinigungsmittel. Haben Sie heiß gebadet oder geduscht, warten Sie, bis Ihre Haut völlig trocken und abgekühlt ist. Tragen Sie auf die ausgewählte Hautstelle keine Lotionen, Cremes oder Salben auf. Sie könnten verhindern, dass das transdermale Pflaster richtig klebt.
Anbringen des transdermalen Pflasters
- Schritt 1: Jedes transdermale Pflaster befindet sich in einem Beutel. Öffnen Sie diesen Beutel erst unmittelbar vor der Anwendung, schneiden Sie den Beutel entlang der Versiegelung mit einer Schere auf. Entnehmen Sie das transdermale Pflaster.

- Schritt 2: Die Klebeseite des transdermalen Pflasters ist mit einer durchsichtigen Schutzfolie versehen. Entfernen Sie vorsichtig einen Teil der Folie. Versuchen Sie, dabei nicht die Klebeschicht zu berühren.

- Schritt 3: Kleben Sie das transdermale Pflaster auf die ausgewählte Hautstelle und entfernen Sie den Rest der Schutzfolie.
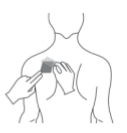
- Schritt 4: Pressen Sie das transdermale Pflaster für ungefähr 30 - 60 Sekunden mit der flachen Hand auf Ihre Haut. Vergewissern Sie sich, dass das gesamte transdermale Pflaster auf der Haut klebt, besonders an den Rändern.
- Schritt 5: Waschen Sie sich nach dem Anbringen des transdermalen Pflasters die Hände. Benutzen Sie dazu keine Reinigungsmittel.
Tragen des transdermalen Pflasters Sie können das transdermale Pflaster bis zu vier Tage auf der Haut tragen. Vorausgesetzt, Sie haben das transdermale Pflaster richtig angebracht, ist ein Ablösen sehr unwahrscheinlich. Während Sie es tragen, können Sie damit duschen, baden oder schwimmen. Hitzeeinwirkung (z. B. Sauna, Infrarot-Bestrahlung, elektrische Wärmedecken, Wärmflaschen) sollte es jedoch nicht ausgesetzt werden.
Im unwahrscheinlichen Fall, dass sich das transdermale Pflaster vor dem nächsten Wechsel löst, benutzen Sie nicht dasselbe transdermale Pflaster nochmals. Kleben Sie umgehend ein neues Pflaster auf (siehe „Wechseln des transdermalen Pflasters“).
Wechseln des transdermalen Pflasters
- Nehmen Sie das alte transdermale Pflaster ab.
- Falten Sie es in der Mitte zusammen, wobei die Klebefläche innen liegen sollte.
- Werfen Sie es sorgsam weg.
- Kleben Sie ein neues transdermales Pflaster auf eine andere geeignete Hautstelle (wie oben beschrieben). Warten Sie mindestens eine Woche, bevor Sie dieselbe Hautstelle wieder bekleben.
Dauer der Anwendung
Ihr Arzt wird Ihnen sagen, wie lange Sie Bupre - 1 A Pharma anwenden sollen. Brechen Sie die Behandlung mit Bupre - 1 A Pharma nicht eigenmächtig ab, da die Schmerzen erneut auftreten und Sie sich unwohl fühlen könnten (siehe auch unten „Wenn Sie die Anwendung von Bupre - 1 A Pharma abbrechen“).
Wenn Sie den Eindruck haben, dass die Wirkung von Bupre - 1 A Pharma zu schwach oder zu stark ist, sprechen Sie mit Ihrem Arzt oder Apotheker.
Wenn Sie eine größere Menge von Bupre - 1 A Pharma angewendet haben, als Sie sollten
Wenn dies passiert, können Anzeichen einer Überdosierung mit dem Wirkstoff Buprenorphin auftreten. Durch eine Überdosis Buprenorphin können die Nebenwirkungen, wie Benommenheit, Übelkeit und Erbrechen, verstärkt werden. Ihre Pupillen können sich stark verengen, und Ihre Atmung kann langsamer und flacher werden. Sie können dabei auch einen Herz-Kreislauf-Kollaps erleiden.
Sobald Sie feststellen, dass Sie mehr transdermale Pflaster aufgeklebt haben, als Sie sollten, entfernen Sie die überzähligen transdermalen Pflaster und sprechen Sie mit einem Arzt oder Apotheker.
Wenn Sie die Anwendung von Bupre - 1 A Pharma vergessen haben
Wenn Sie eine Anwendung vergessen haben, kleben Sie ein neues transdermales Pflaster auf, sobald Sie dies bemerken. Sie müssen dann Ihren Routinewechsel ändern. Wenn Sie z. B. für gewöhnlich das transdermale Pflaster montags und donnerstags wechseln, aber versäumt haben, ein neues transdermales Pflaster aufzukleben und sich erst am Mittwoch daran erinnern, müssen Sie nun das transdermale Pflaster mittwochs und samstags wechseln. Notieren Sie die neuen Tage des Wechsels im Kalender auf dem Umkarton.
Wenn Sie den Zeitpunkt des Wechsels sehr weit überschritten haben, können Ihre Schmerzen erneut auftreten. Wenden Sie sich in diesem Fall bitte an Ihren Arzt.
Sie dürfen auf keinen Fall die vergessene Dosis durch das Aufkleben der doppelten Anzahl an transdermalen Pflastern nachholen.
Wenn Sie die Anwendung von Bupre - 1 A Pharma abbrechen
Wenn Sie die Behandlung mit Bupre - 1 A Pharma unterbrechen oder vorzeitig beenden, kann dies zu einem erneuten Auftreten der Schmerzen führen. Möchten Sie die Behandlung wegen unangenehmer Nebenwirkungen abbrechen, wenden Sie sich bitte an Ihren Arzt. Er wird mit Ihnen besprechen, welche Gegenmaßnahmen es hierfür gibt und ob andere Arzneimittel für die Behandlung in Frage kommen.
Wenn starke Schmerzmittel über einen längeren Zeitraum angewendet werden und die Behandlung beendet wird, kann es bei manchen Menschen zu Entzugserscheinungen kommen. Das Risiko für Entzugserscheinungen ist nach dem Absetzen von Bupre - 1 A Pharma sehr gering. Wenn Sie sich dennoch unruhig, ängstlich, nervös oder zittrig fühlen, überaktiv sind, nicht schlafen können oder Verdauungsbeschwerden haben, sprechen Sie mit Ihrem Arzt.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4 Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Wenn Sie Schwellungen an Händen, Füßen, Knöcheln, Gesicht, Lippen, Mund oder Kehle mit Schluck- oder Atembeschwerden, Nesselausschlag, Ohnmacht, Gelbfärbung der Haut und Augen (auch Gelbsucht genannt) beobachten, entfernen Sie das transdermale Pflaster und rufen Sie unverzüglich Ihren Arzt an oder suchen Sie Hilfe in der Notambulanz des nächsten Krankenhauses. Dies können Symptome einer sehr seltenen, ernst zu nehmenden allergischen Reaktion sein.
Folgende Nebenwirkungen wurden berichtet:
Sehr häufig (kann mehr als 1 von 10 Behandelten betreffen)
- Übelkeit
- Hautrötung, Jucken
Häufig (kann bis zu 1 von 10 Behandelten betreffen)
- Schwindel, Kopfschmerz
- Kurzatmigkeit
- Erbrechen, Verstopfung
- Hautveränderungen (Exanthem, im Allgemeinen bei wiederholter Pflasteranwendung), Schwitzen
- Ödeme (z. B. Schwellung der Beine), Müdigkeit
Gelegentlich (kann bis zu 1 von 100 Behandelten betreffen)
- Verwirrtheit, Schlafstörungen, Unruhe
- Sedierung (Beruhigung) in unterschiedlichem Ausmaß, von leichter Müdigkeit bis zur Benommenheit
- Kreislaufstörungen (wie niedriger Blutdruck oder in seltenen Fällen sogar Kreislaufkollaps)
- Mundtrockenheit
- Hautausschlag
- Schwierigkeiten beim Wasserlassen oder Harnverhalten (weniger Urin als normal)
- Abgeschlagenheit
Selten (kann bis zu 1 von 1.000 Behandelten betreffen)
- Appetitverlust
- Sinnes- und Wahrnehmungstäuschungen, Angstzustände und Albträume, vermindertes sexuelles Interesse
- Konzentrationsstörungen, Sprachstörungen, Benommenheit, Gleichgewichtsstörungen, Missempfindungen der Haut (z. B. Taubheitsgefühl, Hautprickeln oder brennende Hautirritationen)
- Sehstörungen, verschwommenes Sehen, Schwellung der Augenlider
- Hitzewallungen
- eingeschränkte Atemtätigkeit (Atemdepression)
- Sodbrennen
- Nesselausschlag
- Erektionsschwäche
- Entzugserscheinungen (siehe unten), lokale Nebenwirkungen
Sehr selten (kann bis zu 1 von 10.000 Behandelten betreffen)
- schwere allergische Reaktionen (siehe unten)
- Abhängigkeit, Stimmungsschwankungen
- Muskelzuckungen, Geschmacksstörungen
- Pupillenverengung
- Ohrenschmerzen
- rasches Atmen (Hyperventilation), Schluckauf
- Brechreiz
- Pusteln, kleine Hautbläschen
- Brustschmerz
Sollten Sie eine der oben aufgeführten Nebenwirkungen bemerken, informieren Sie so bald wie möglich Ihren Arzt.
In einigen Fällen traten verzögert allergische Reaktionen mit deutlichen Entzündungsmerkmalen auf. In diesen Fällen soll die Behandlung mit Bupre - 1 A Pharma beendet werden, nachdem Sie mit Ihrem Arzt darüber gesprochen haben.
Manche Menschen können Entzugssymptome entwickeln, wenn sie über einen längeren Zeitraum starke Schmerzmittel angewendet haben und die Behandlung abbrechen. Das Risiko für Entzugssymptome, wenn Sie die Behandlung mit Bupre - 1 A Pharma beenden, ist dabei gering.
Wenn Sie sich jedoch unruhig, ängstlich, nervös oder zittrig fühlen, wenn Sie hyperaktiv sind, Schlaf- oder Verdauungsstörungen haben, sprechen Sie mit Ihrem Arzt.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
D-53175 Bonn
Website: www.bfarm.de
anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5 Wie ist Bupre - 1 A Pharma aufzubewahren?
- Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
- Sie dürfen dieses Arzneimittel nach dem auf dem Umkarton und dem Beutel nach „verwendbar bis“ angegebenen Verfallsdatum nicht mehr verwenden. Das Verfallsdatum bezieht sich auf den letzten Tag des angegebenen Monats.
- Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
- Falten Sie das Pflaster nach dem Entfernen mit der Klebefläche nach innen und drücken Sie es zusammen. Legen Sie das benutzte transdermale Pflaster wieder in den Beutel und entsorgen Sie es sorgsam.
- Entsorgen Sie Arzneimittel nicht im Abwasser. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6 Inhalt der Packung und weitere Informationen
Was Bupre - 1 A Pharma enthält
Der Wirkstoff ist Buprenorphin.
Bupre - 1 A Pharma 35 Mikrogramm/Stunde
Jedes transdermale Pflaster mit einer wirkstoffhaltigen Fläche von 25 cm2 enthält 20 mg Buprenorphin und setzt 35 Mikrogramm Buprenorphin pro Stunde frei.
Bupre - 1 A Pharma 52,5 Mikrogramm/Stunde
Jedes transdermale Pflaster mit einer wirkstoffhaltigen Fläche von 37,5 cm2 enthält 30 mg Buprenorphin und setzt 52,5 Mikrogramm Buprenorphin pro Stunde frei.
Bupre - 1 A Pharma 70 Mikrogramm/Stunde
Jedes transdermale Pflaster mit einer wirkstoffhaltigen Fläche von 50 cm2 enthält 40 mg Buprenorphin und setzt 70 Mikrogramm Buprenorphin pro Stunde frei.
Die sonstigen Bestandteile sind:
Selbstklebende Matrix (mit Buprenorphin): Povidon K90, 4-Oxopentansäure, Oleyloleat, Poly[acrylsäure-co-butylacrylat-co-(2- ethylhexyl)acrylat-co-vinylacetat] (5:15:75:5)
Selbstklebende Matrix (ohne Buprenorphin): Poly[(2-ethylhexyl)acrylat-co-glycidylmethacrylat-co-(2-hydroxyethyl)acrylat-co-vinylacetat] (68:0,15:5:27)
Trennfolie zwischen den beiden selbstklebenden Matrizes mit und ohne Buprenorphin: Poly(ethylenterephthalat)
Trägerschicht: Polyester
Schutzfolie: Poly(ethylenterephthalat), silikonisiert
blaue Drucktinte
Wie Bupre - 1 A Pharma aussieht und Inhalt der Packung
Jedes transdermale Pflaster ist rechteckig und hautfarben, hat abgerundete Ecken und ist in blauer Tinte bedruckt mit
Bupre - 1 A Pharma 35 Mikrogramm/Stunde „Buprenorphin“ und „35 μg/h“
Bupre - 1 A Pharma 52,5 Mikrogramm/Stunde „Buprenorphin“ und „52,5 μg/h“
Bupre - 1 A Pharma 70 Mikrogramm/Stunde „Buprenorphin“ und „70 μg/h“
Jedes transdermale Pflaster ist einzeln in einem kindergesicherten Beutel eingesiegelt.
Die Pflaster sind erhältlich in Packungen mit 4, 5, 8, 10, 16 oder 20 transdermalen Pflastern.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer
1 A Pharma GmbH
Keltenring 1 + 3
82041 Oberhaching
Telefon: (089) 6138825-0
Hersteller
Salutas Pharma GmbH
Otto-von-Guericke-Allee 1
39179 Barleben
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Deutschland: Bupre - 1 A Pharma 35/52,5/70 Mikrogramm/Stunde transdermales Pflaster
Tschechische Republik: Buprenorphine Sandoz 35/52,5/70 mikrogramů/h, transdermální náplast
Polen: Norvipren
Diese Packungsbeilage wurde zuletzt überarbeitet im Februar 2016.
Salutas Pharma GmbH
7 Preisvergleich - Bupre - 1 A Pharma transdermales Pflaster
Bupre - 1 A Pharma transdermales Pflaster Preisvergleich
Für den Kauf empfehlen wir Ihnen den Apothekenpreisvergleich Sparmedo.de. Dort werden die Preise von über 70 zertifizierten Versandapotheken verglichen, wodurch Bupre - 1 A Pharma transdermales Pflaster günstig bestellt werden kann.
Preise vergleichen